358
473
всего разделов:
активных пользователей:
30 мартра 2005
Форумы снова функционируют.
21 декабря 2004
Видимо в связи с обнаруженными дырами в phpBB, форум был взломан, а через него взломано и всё остальное содержимое ceemat.ru. Всё кроме форума восстановлено, ведется дискуссия по поводу его сохранения.
Приносим извинения за неудобства.
29 сентября 2004
Форум обновился до версии 2.0.10
15 мая 2004
Новый раздел: "Программирование"
16 апреля 2004 года
Задачи Ярославского турнира математических боев — 124 задачи с решениями.
29 марта 2004
Таллинская викторина: занимательные вопросы и задачи для увлеченных химией.
11 класс (10)
Навеску некоторого углеводорода Х сожгли в атмосфере газа А и после охлаждения до 20 °С газообразные продукты пропустили через избыток раствора Са(OH)2. При этом выделилось 6,24 г белого осадка. Сжигание другой навески такой же массы в другом газе В и пропускание продуктов горения через избыток раствора Ca(OH)2 дает 16,0 г белого осадка. Известно, что Х не реагирует с бромом в присутствии железа, а при облучении светом и действии Cl2 дает только одно монохлорпроизводное. При взаимодействии Х с горячим водным раствором KMnO4 образуется вещество Y, способное прореагировать с 12-кратным количеством соляной кислоты.
|
1. Углеводороды горят в кислороде, хлоре и фторе: СxHy + (x + 0,25y)O2 = xCO2 + 0,5yH2O; СxHy + (2x + 0,5y)F2 = xCF4 + yHF ; СxHy + (2x + 0,5y)Cl2 = xCCl4 + yHCl При пропускании продуктов горения в раствор Са(OH)2 могут происходить следующие реакции: Ca(OH)2 + CO2 = CaCO3 + H2O; Ca(OH)2 + 2HF = CaF2 + 2H2O; Ca(OH)2 + 2HCl = CaCl2 + 2H2O CF4 и CCl4 c раствором Са(ОН)2 при 25 °C не реагируют. Хлорид кальция хорошо растворим в воде и осадка не образует. Таким образом, получены осадки СаСО3 и CaF2. Из этого следует, что газы А и В — кислород и фтор. Из одного моля углеводорода СxНy при сгорании в кислороде образуется х молей СО2, который при поглощении Са(ОН)2 дает х молей, или 100х г СаСО3. При сгорании во фторе из одного моля углеводорода СxНy образуется y молей НF, который дает 0,5y молей, или 39y г СаF2. Из углеводорода состава СxН2x + 2 образуются осадки массой m(CaCO3) = 100x г и m(CaF2) = = 39(2x + 2) = 78x + 78 г. Легко видеть, что только для метана, этана и пропана (x < 4) масса осадка СаF2 больше массы осадка СаСО3. Для всех остальных углеводородов соотношение обратное. Поэтому мы можем предположить, что газ В — кислород, газ А — фтор. 2. При пропускании продуктов горения в кислороде в раствор Са(ОН)2 получено 16 г, или 0,16 моля СаСО3. Следовательно, в навеске содержится 0,16 моля С. При пропускании продуктов горения во фторе в раствор Са(ОН)2 получено 6,24 г, или 0,08 моля СаF2. Следовательно, в навеске содержится 0,16 моля Н. Простейшая формула углеводорода (СН)n. Небольшое содержание водорода дает основание предположить, что в состав Х входят либо тройные связи, либо ароматические кольца. Так как вещество Х не взаимодействует с хлором в условиях электрофильного присоединения или замещения, оно не содержит алифатических кратных связей и незамещенных ароматических С-Н-групп. Образование одного монохлорпроизводного в условиях радикального хлорирования означает, что в молекуле Х все атомы водорода эквивалентны. Условию эквивалентности монохлорпроизводных могут отвечать только метильные группы. Таким образом, вещество Х представляет собой полиароматическое соединение. При действии KMnO4 в нейтральной среде метильные группы окисляются до карбоксильных, при этом образуются калиевые соли карбоновых кислот. Вещество Y является средней калиевой солью поликарбоновой кислоты, которая при взаимодействии с соляной кислотой последовательно образует ряд кислых солей и в конечном счете соответствующую карбоновую кислоту. Таким образом, число продуктов взаимодействия калиевой соли с сильной кислотой равно числу карбоксильных групп, а следовательно, числу метильных заместителей в структуре углеводорода Х. Значит, Х содержит 12 метильных групп, то есть 36 атомов Н, что соответствует формуле С36Н36. Условию эквивалентности 12 метильных групп может соответствовать только высокосимметричная структура, скорее всего циклическая. Остаток после мысленного удаления метильных групп представляет собой углеродный скелет, не содержащий водорода. Таким скелетом может быть только система конденсированных бензольных колец. Искомый углеводород — додекаметилкоронен: 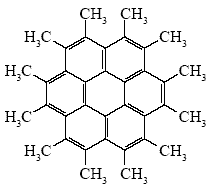
3. Уравнения реакций: C24(CH3)12 + 24KMnO4 = C24(COOK)12 + 24MnO2 + 12KOH + 12H2O;
|
8 Января 2004 15:28 Раздел каталога :: Ссылка на задачу
|