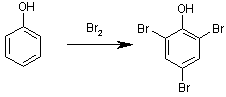358
469
всего разделов:
активных пользователей:
30 мартра 2005
Форумы снова функционируют.
21 декабря 2004
Видимо в связи с обнаруженными дырами в phpBB, форум был взломан, а через него взломано и всё остальное содержимое ceemat.ru. Всё кроме форума восстановлено, ведется дискуссия по поводу его сохранения.
Приносим извинения за неудобства.
29 сентября 2004
Форум обновился до версии 2.0.10
15 мая 2004
Новый раздел: "Программирование"
16 апреля 2004 года
Задачи Ярославского турнира математических боев — 124 задачи с решениями.
29 марта 2004
Таллинская викторина: занимательные вопросы и задачи для увлеченных химией.
10 класс (6)
Согласно одной из существующих методик количественного определения фенола в воде, к пробе, подкисленной соляной кислотой, добавляют растворы бромида и бромата калия, а затем раствор иодида калия. Выделяющийся иод титруют раствором тиосульфата натрия. Какие химические реакции заложены в схему определения фенола? Напишите их уравнения. Применим ли метод к замещённым фенолам? Какие условия должны быть соблюдены, чтобы указанный метод дал точные результаты? |
Фенол — ядовитое вещество, которое может содержаться в сточных водах промышленных предприятий. Чтобы убедиться, что сточные воды достаточно хорошо очищены, нужно уметь определять в них малые концентрации вредных компонентов, в том числе фенола. Метод, описанный в задаче, основан на реакции фенола с бромом, которая протекает следующим образом:
Вещество 2,4,6-трибромфенол — твёрдое, выпадает в осадок. Бром, необходимый для бромирования фенола, образуется в реакционной смеси при взаимодействии бромида и бромата калия в кислой среде: 5KBr + KBrO3 + 6HCl = 6KCl + 3Br2 + 3H2O Избыток брома, оставшийся после связывания всего фенола, взаимодействует с иодидом калия Br2 + 2KI = I2 + 2KBr И, наконец, выделяющийся иод титруют раствором тиосульфата натрия. При этом реакция протекает по уравнению: 2Na2S2O3 + I2 = Na2S4O6 + 2NaI Соединение Na2S4O6, которое при этом образуется, называется тетратионат натрия. Реакция иода с тиосульфатом натрия часто используется в окислительно-восстановительном титровании, так как она протекает быстро и количественно. Кроме того, конечную точку титрования легко обнаружить, так как иод образует с крахмалом интенсивно окрашенный сине-фиолетовый комплекс. Перед титрованием в раствор добавляют несколько капель раствора крахмала, при этом сразу же появляется сине-фиолетовая окраска, так как раствор содержит иод. По мере прибавления Na2S2O3, иод постепенно расходуется. В тот момент, когда добавленное количество тиосульфата точно эквивалентно количеству иода, реакция проходит полностью (иода не остаётся), и окраска исчезает. Это и есть конечная точка титрования. По количеству раствора Na2S2O3, израсходованного к этому моменту, рассчитывают количество иода, которое получилось в реакции с бромом, а по нему - количество брома, которое осталось после взаимодействия с фенолом. Поскольку мы можем определить исходное количество брома, которое получилось в растворе из бромата и бромида, то теперь по разности можно узнать количество брома, которое пошло на реакцию с фенолом и, наконец, количество фенола. Конечно, нет никакой надобности каждый раз проводить всю эту последовательность расчётов. При разработке методики обычно сразу выводят формулу, по которой искомую величину можно определить непосредственно из количества затраченного реагента, в данном случае концентрация фенола в воде будет сразу определяться при подстановке в формулу количества тиосульфата натрия. Метод применим к любым фенолам, которые содержат СН-связи, активированные к реакции с галогеном. В самом феноле, как мы видим, — это связи при 2, 4 и 6 атомах углерода. Естественно, в случае замещённых фенолов необходимо знать количество реагирующих СН-связей, чтобы правильно рассчитать массу определяемого фенола. Если все указанные положения заняты другими заместителями, как, например, в Чтобы метод дал точные результаты, необходимо соблюдать следующие правила: количество бромида в растворе должно быть как минимум в 5 раз больше количества бромата (иначе выделяться будут Cl2 и Br2), соляной кислоты должно быть не очень много, так как тиосульфат натрия нестоек в кислой среде. |
15 Февраля 2004 18:48 Раздел каталога :: Ссылка на задачу
|