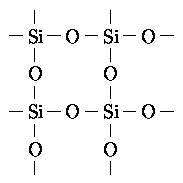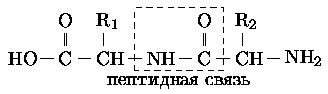358
473
всего разделов:
активных пользователей:
30 мартра 2005
Форумы снова функционируют.
21 декабря 2004
Видимо в связи с обнаруженными дырами в phpBB, форум был взломан, а через него взломано и всё остальное содержимое ceemat.ru. Всё кроме форума восстановлено, ведется дискуссия по поводу его сохранения.
Приносим извинения за неудобства.
29 сентября 2004
Форум обновился до версии 2.0.10
15 мая 2004
Новый раздел: "Программирование"
16 апреля 2004 года
Задачи Ярославского турнира математических боев — 124 задачи с решениями.
29 марта 2004
Таллинская викторина: занимательные вопросы и задачи для увлеченных химией.
10 класс (6)
Известно, что атомы углерода способны соединяться друг с другом, образуя цепочки -C-C-C- Именно это является причиной чрезвычайного многообразия существующих органических соединений. Какие ещё типы веществ вы знаете, где атомы (не обязательно одинаковые) образуют длинные цепочки? Какие типы химической связи в них реализуются? Приведите примеры. |
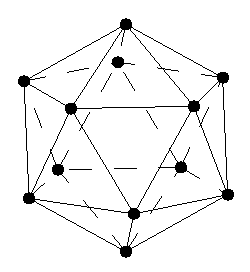
Некоторые простые вещества образуют длинные цепочки ковалентно связанных атомов. Как правило, такие вещества имеют много аллотропных модификаций и в соединениях также склонны к образованию полимеров. Сера. Обычно элементная сера состоит из восьми атомов, которые могут быть по-разному упакованы в кристаллическою решетку. Кроме того, существует неустойчивая пластическая сера — хаотично переплетенные зигзагообразные длинные цепи. В соединениях сера также часто образовывает длинные полимерные цепи, в которых звенья могут соединяться через атомы кислорода или самой серы. Состав и строение таких веществ зависит от условий получения. Бор. Имеет более 10 аллотропных модификаций. Атомы бора в них объединены в группировки B12, имеющие формы икосаэдра — двадцатигранника.
Гидриды бора (бораны) образуют довольно сложные по структуре соединения с многоцентровыми связями. Особенно интересные структуры образуют кислородные соединения бора. Это могут быть плоские зигзагообразные цепи, соединённые друг с другом тетраэдры, "соты" и т. д. Фосфор. Фосфор имеет большое число аллотропных модификаций, из которых важнейшие — белый и красный фосфор. В пара он находится в виде четырёхатомной молекулы P4, при конденсации образуется белый фосфор P4, который при длительном хранении или нагревании переходит в полимер — красный фосфор. Ещё одна аллотропная (или аллотропическая) модификация — чёрный фосфор — имеющая структуру, похожую на графит, состоит из гофрированных слоёв. Во всех модификациях фосфор связан с тремя своими соседями. Фосфор может также образовывать цепочки (не очень длинные) и в соединениях с кислородом. Кремний. Простое вещество, имеет алмазоподобную модификацию. Соединения кремния с кислородом образуют большой класс соединений — оксисиликаты. В основе их лежит структура, изображенная на рисунке.
Каждый кислород связан с двумя атомами кремния, а каждый кремний — с четырьмя кислородами. Взаимное пространственное расположение этих атомов может быть очень разным, кроме того, в структуру оксисиликатов входят различные ионы. И все вместе они образуют очень длинные и разветвлённые цепи, сети и пространственные структуры. Биополимеры. Многие биологически активные вещества имеют вид длинных цепочек. Кроме связей С-С встречаются связи с азотом, например, в белках, представляющих из себя длинные последовательности аминокислот, они соединяются между собой пептидной связью.
Водородная связь. Во всех перечисленных выше примерах образовыванию длинных цепочек служила ковалентная (как полярная, так и неполярная) связь. Другой пример связи — водородная. Водородная связь — это электростатическое взаимодействие водорода, несущего большой положительный заряд, с атомом, несущим большой отрицательный заряд. Например, молекулы воды образуют не просто цепи, а целую решётку из молекул. Конечно, эти связи очень непрочные, но, тем не менее, они оказывают серьёзное влияние на свойства веществ. В этом можно убедится, сравнив температуры кипения воды и сероводорода и других гидридов элементов VI группы — у воды температура кипения аномально высокая. Обратите внимание, что между молекулами HF очень сильные водородные связи, так как фтор электроотрицательнее водорода, но температура кипения HF гораздо ниже, чем у воды. Это объясняется тем, что молекулы фтороводорода "слипаются", образуя димеры, а не разветвлённые цепи связанных между собой молекул, как H2O. |
15 Февраля 2004 18:39 Раздел каталога :: Ссылка на задачу
|