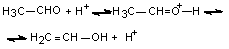358
475
всего разделов:
активных пользователей:
30 мартра 2005
Форумы снова функционируют.
21 декабря 2004
Видимо в связи с обнаруженными дырами в phpBB, форум был взломан, а через него взломано и всё остальное содержимое ceemat.ru. Всё кроме форума восстановлено, ведется дискуссия по поводу его сохранения.
Приносим извинения за неудобства.
29 сентября 2004
Форум обновился до версии 2.0.10
15 мая 2004
Новый раздел: "Программирование"
16 апреля 2004 года
Задачи Ярославского турнира математических боев — 124 задачи с решениями.
29 марта 2004
Таллинская викторина: занимательные вопросы и задачи для увлеченных химией.
11 класс (6)
Предельные углеводороды реагируют с бромом, но не реагируют с йодом. Предельные оксосоединения реагируют и с бромом, и йодом. Скорость реакции мало зависит от природы галогена, но сильно зависит от концентрации в реакционной смеси кислот и оснований. а) Объясните, почему происходит бромирование, но не йодирование алканов; б) предложите механизмы реакций галогенирования оксосоединений в кислой и щелочной средах; в) почему в щелочной среде легкость бромирования возрастает в ряду H3CCOCH3 < H3CCOCH2Br < H3CCOCHBr2. Сохранится ли этот порядок в кислой среде? |
Взаимодействие галогенов с предельными углеводородами происходит по свободнорадикальному механизму. Реакцию CH4 + Br2 = CH3Br + HBr сопровождает уменьшение энергии Гиббса (реакция экзотермическая, изменение энтропии незначительно). Для реакции CH4 + I2 = CH3I + HI ΔG>0 (реакция эндотермическая, вклад энтропийного члена невелик). В оксосоединениях связи С-Н, соседние с карбонильной группой, активированы вследствие электроноакцепторного влияния последней, и атомы водорода приобретают подвижность. Например, в случае ацетальдегида под действием оснований в малых концентрациях образуются анионы -CH2–CH=O (стабилизация за счет резонанса ([-H2C-CH=O] ↔ [CH2=CH-O-]), способные быстро и необратимо по электрофильному механизму реагировать с галогенами: –H2C–CH=O + δ+Br–Brδ- → BrH2C–CH=O + Br–. Введение в молекулу ацетона обладающих электроноакцепторными свойствами атомов брома ведет к дальнейшему активированию связи С–Н. В кислой среде существует равновесие между кето- и енольной формами:
Енольная форма по электрофильному механизму быстро реагирует с молекулой галогена (с последующим отщеплением галогеноводорода): H2C=CH-OH + Br2 → BrH2C–CH(Br)OH → BrH2C–CH=O + HBr. Енолизация альдегидов и кетонов в кислой среде связана со способностью атома кислорода карбонильной группы присоединять ион водорода; введение в молекулу ацетона атомов брома снижает отрицательный заряд на атоме кислорода и, следовательно, в кислой среде легкость бромирования снижается в ряду соединений H3CCOCH3 > H3CCOCH2Br > H3CCOCHBr2. |
20 Января 2004 19:18 Раздел каталога :: Ссылка на задачу
|