358
476
всего разделов:
активных пользователей:
30 мартра 2005
Форумы снова функционируют.
21 декабря 2004
Видимо в связи с обнаруженными дырами в phpBB, форум был взломан, а через него взломано и всё остальное содержимое ceemat.ru. Всё кроме форума восстановлено, ведется дискуссия по поводу его сохранения.
Приносим извинения за неудобства.
29 сентября 2004
Форум обновился до версии 2.0.10
15 мая 2004
Новый раздел: "Программирование"
16 апреля 2004 года
Задачи Ярославского турнира математических боев — 124 задачи с решениями.
29 марта 2004
Таллинская викторина: занимательные вопросы и задачи для увлеченных химией.
2-ая олимпиада, 2002 год (10)
10,00 г амальгамы некоторого металла растворили в избытке концентрированной азотной кислоты. Полученный раствор выпарили, а остаток прокалили под тягой до постоянной массы при температуре 673 К. Эта масса оказалась равной 0,81 г. Полученное после прокаливания вещество не растворяется в воде, однако хорошо растворяется в концентрированном растворе щелочи. При восстановлении углем 1,000 г этого вещества получается 0,803 г металла. Амальгама какого металла была взята и какова массовая доля этого металла в амальгаме (в мас.%)? |
В результате растворения в избытке концентрированной азотной кислоты образовался нитрат ртути и нитрат неизвестного металла. При прокаливании при Т = 773 K нитраты металлов разлагаются, причем из образца удаляется также ртуть: Поскольку оксид неизвестного растворяется в щелочи, значит речь идет об амфотерном оксиде. При прокаливании оксида с углем происходит реакция: Эквивалент металла находим по закону эквивалентов: М(экв. Ме) = 8 · 0,803/(1 - 0,803) = 32,6 г/моль-экв. Если метал двухвалентен, его молярная масса равна 65,2 (Zn). Кол-во оксида цинка |
7 Января 2004 23:33 Раздел каталога :: Ссылка на задачу
|
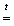 Hg + O2 + NO2.
Hg + O2 + NO2.