358
470
всего разделов:
активных пользователей:
30 мартра 2005
Форумы снова функционируют.
21 декабря 2004
Видимо в связи с обнаруженными дырами в phpBB, форум был взломан, а через него взломано и всё остальное содержимое ceemat.ru. Всё кроме форума восстановлено, ведется дискуссия по поводу его сохранения.
Приносим извинения за неудобства.
29 сентября 2004
Форум обновился до версии 2.0.10
15 мая 2004
Новый раздел: "Программирование"
16 апреля 2004 года
Задачи Ярославского турнира математических боев — 124 задачи с решениями.
29 марта 2004
Таллинская викторина: занимательные вопросы и задачи для увлеченных химией.
10 класс (5)
Юный химик хотел получить порошок металлической меди, для чего он растворил в стакане воды 8.5 г зеленого порошка двуххлористой меди и бросил в раствор 10 г алюминиевой проволоки. В стакане быстро началась реакция, однако вместо порошка металлической меди образовалась бурая масса, стакан сильно нагрелся, и из него выделился газ объемом 8.7 л |
Раствор хлористой меди снимает с алюминия окисную пленку, в результате чего затем протекают следующие реакции: I. 3CuCl2 + 2Al = 3Cu + 2AlCl3 II. Al + 3H2O = Al(OH)3 + 1.5H2↑ Таким образом, выделившийся газ — это водород. Пренебрегая объемом паров воды, можно вычислить, что водорода образовалось 8,7 · 273/(22,4 · 353) = 0,3 моля, что означает, что по реакции II прореагировало 0,2 моля алюминия, или 5,4 г. Кроме реакций I и II, происходит образование гидроксида меди с последующим его разложением при высокой температуре, что смещает равновесие в реакции III: III. 3CuCl2 + 2Al(OH)3 = 3Cu(OH)2 + 2AlCl3 IV. Cu(OH)2 Пренебрегая гидролизом AlCl3, рассчитаем его содержание в смеси. Очевидно, что весь хлорид-ион приходит из хлористой меди. Учитывая, что зеленый порошок двуххлористой меди является дигидратом, вычисляем его количество: 8,5/170,5 = 0,05 моль, из которых может образоваться 0,033 моль хлорида алюминия. Таким образом, по завершении реакции в реакционной смеси содержится 0,033 моль хлорида алюминия, суммарно 0,05 моль металлической меди и окиси меди. Содержание Al(OH)3 составляет не более 0,2 моль, или 15,6 г. Кроме того, можно утверждать, что металлического алюминия осталось меньше чем 10 - 5,4 = 4,6 г., но не менее чем 4,6 - 27 · 0,033 = 3,71 г, в предположении, что хлористая медь расходовалась только по реакции I. Отметим, что образование металлической меди обычно незначительно. |
25 Декабря 2003 15:09 Раздел каталога :: Ссылка на задачу
|
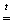 CuO + H2O
CuO + H2O