358
469
всего разделов:
активных пользователей:
30 мартра 2005
Форумы снова функционируют.
21 декабря 2004
Видимо в связи с обнаруженными дырами в phpBB, форум был взломан, а через него взломано и всё остальное содержимое ceemat.ru. Всё кроме форума восстановлено, ведется дискуссия по поводу его сохранения.
Приносим извинения за неудобства.
29 сентября 2004
Форум обновился до версии 2.0.10
15 мая 2004
Новый раздел: "Программирование"
16 апреля 2004 года
Задачи Ярославского турнира математических боев — 124 задачи с решениями.
29 марта 2004
Таллинская викторина: занимательные вопросы и задачи для увлеченных химией.
9 класс (5)
Желая получить вожделенную для многих пиротехников соль, юный химик растворил в воде 20 г хромового ангидрида и стал медленно пропускать в раствор аммиак. Дождавшись прекращения поглощения газа, он разобрал прибор и осторожно испарил раствор на вакуумном испарителе. Удался ли юному химику опыт, который он мечтал провести с полученным веществом и что это за опыт? Какова масса полученного им соединения и сколько должен был весить предмет его вожделений? Как бы Вы действовали на его месте, имея 20 г хромового ангидрида и не имея возможности контролировать объем пропущенного газа? |
Интересующая пиротехников соль, получаемая взаимодействием аммиака с раствором хромового ангидрида — дихромат аммония, реакция разложения которого сильно экзотермична и после инициирования имитирует разложение вулкана. 2NH3 + 2CrO3 + H2O = (NH4)2Cr2O7 Однако, раствор дихромата аммония имеет заметно кислую реакцию и будет поглощать аммиак до образования хромата аммония: (NH4)2Cr2O7 + 2NH3 + H2O = 2(NH4)2CrO4 Его и получил юный химик, осторожно испарив раствор. Разложение хромата аммония протекает без спецэффектов и требует нагревания: Таким образом, можно сказать, что опыт ему не удался. Масса полученного им вещества составила (20/100) · 152 = 30,4 г, в то время как дихромат должен был бы весить 20/(100 · 2) · 252 = 25,2 г. Для получения вожделенной соли ему следовало провести опыт с половиной CrO3, т.е. с 10 г, растворить полученное соединение в растворе второй половины хромового ангидрида, а затем испарить раствор. |
25 Декабря 2003 15:14 Раздел каталога :: Ссылка на задачу
|
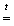 N2 + Cr2O3 + 5H2O + 2NH3
N2 + Cr2O3 + 5H2O + 2NH3