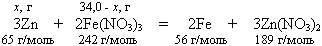358
476
всего разделов:
активных пользователей:
30 мартра 2005
Форумы снова функционируют.
21 декабря 2004
Видимо в связи с обнаруженными дырами в phpBB, форум был взломан, а через него взломано и всё остальное содержимое ceemat.ru. Всё кроме форума восстановлено, ведется дискуссия по поводу его сохранения.
Приносим извинения за неудобства.
29 сентября 2004
Форум обновился до версии 2.0.10
15 мая 2004
Новый раздел: "Программирование"
16 апреля 2004 года
Задачи Ярославского турнира математических боев — 124 задачи с решениями.
29 марта 2004
Таллинская викторина: занимательные вопросы и задачи для увлеченных химией.
3. Заочный тур. 11 класс. (5)
Распределение баллов по задачам:
| Задача | 1 | 2 | 3 | 4 | 5 |
| Баллы | 3 | 4 | 5 | 6 | 7 |
Цинковую пластинку массой 13,2 г опустили в 300,0 г раствора нитрата железа (III) с массовой долей соли 11,34%. После некоторого выдерживания пластинки в растворе ее вынули, при этом оказалось, что массовая доля нитрата железа (III) стала равной массовой доле образовавшейся соли цинка. Определите массу пластинки, после того как ее вынули из раствора. |
Ответ: масса пластинки после реакции составит 10,5 г. 1. Напишем уравнение реакции, отражающее химизм процессов, описанных в задаче. Согласно значениям ЭДС реакция может протекать в две стадии: Zn + 2Fe(NO3)3 = 2Fe(NO3)2 + Zn(NO3)2; Zn + Fe(NO3)2 = Fe + Zn(NO3)2. И суммарно:
2. Найдем массу нитрата железа (III) в растворе: m(Fe(NO3)3) = ν(Fe(NO3)3) · mр-ра = 0,1134 · 300,0 г = 34,0 г. 2. После того как вынули пластинку из раствора, массовые доли нитрата железа (III) и нитрата цинка стали равными, это значит, что массы нитрата железа (III) и нитрата цинка одинаковы: m(Fe(NO3)3) = m(Zn(NO3)2). 3. Обозначим m(Zn(NO3)2) = х г. Тогда m(Fe(NO3)3) = (34,0 - х) г. По уравнению реакции (34,0 - x) / 2 · 242 = x/3 · 189. Отсюда х = 18,4 г. Найдем количество вещества нитрата цинка: ν(Zn(NO3)2) = m(Zn(NO3)2) / M(Zn(NO3)2) = 18,4 г / 189 г/моль = 0,0974 моль. 4. Согласно уравнению реакции ν(Zn(NO3)2) = ν(Zn) = 0,0974 моль; m(Zn) = ν(Zn) · М(Zn) = 0,0974 · 65,0 г/моль = 6,33 г. ν(Fe) = 2/3 · ν(Zn(NO3)2) = 0,0649 моль; m(Fe) = ν(Fe) · М(Fe) = 0,0649 моль · 56,0 г/моль = 3,63 г. 5. Масса цинковой пластинки после реакции складывается из исходной массы пластинки за вычетом прореагировавшего цинка и массы осадившегося железа: m(пластинки) = m(пластинки до реакции) - m(Zn) + m(Fe) = = 13,2 г - 6,33 г + 3,63 г = 10,5 г. |
18 Декабря 2003 13:25 Раздел каталога :: Ссылка на задачу
|